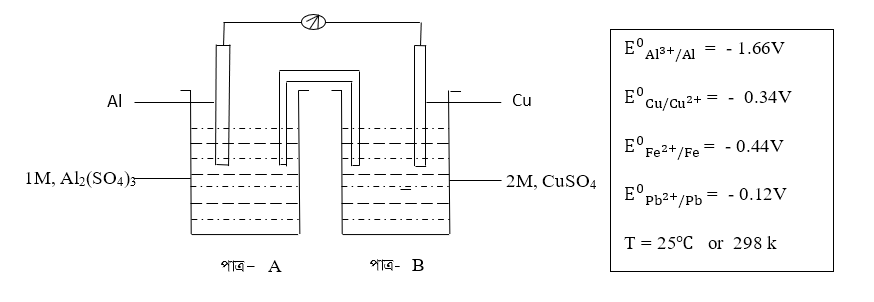
ক) উদ্দীপকের কোষটির পূর্ণ কোষ বিক্রিয়া এবং কোষ সংকেত বা কোষ ডায়াগ্রাম লিখ ।
খ) উদ্দীপকের কোষটির প্রমাণ কোষ বিভব(Standard Cell Potential)বা প্রমাণ তড়িৎ চালক বল(Electro Motive Force বা EMF) বা E0cellএর মান নির্ণয় কর ।
গ) উদ্দীপকের কোষের A পাত্রটি যদি লোহা নির্মিত হয় তবে A পাত্রে Al2(SO4)3 দ্রবণ রাখা যাবে কি ? গাণিতিকভাবে বিশ্লেষণ করো।
ঘ) উদ্দীপকের কোষের B পাত্রটি যদি লেড নির্মিত হয় তবে B পাত্রে CuSO4 দ্রবণ রাখা যাবে কি ? গাণিতিকভাবে বিশ্লেষণ করো।
ঙ) উদ্দীপকের কোষটির কোষ বিভব(Cell Potential) অথবা Ecell এর মান নির্ণয় কর।
ক নং প্রশ্নের উত্তর – উদ্দীপকের কোষটির পূর্ণ কোষ বিক্রিয়া এবং কোষ সংকেত বা কোষ ডায়াগ্রাম
অ্যানোড তড়িৎদ্বারে বিক্রিয়া(জারন): Al → Al3+ + 3e–
ক্যাথোড তড়িৎদ্বারে বিক্রিয়া(বিজারন): Cu2+ + 2e– → Cu
(i) ×2 এবং (ii) ×3 করে যোগ করি-
অ্যানোড তড়িৎদ্বারে বিক্রিয়া(জারন): 2Al → 2Al3+ + 6e–
ক্যাথোড তড়িৎদ্বারে বিক্রিয়া(বিজারন): 3Cu2+ + 6e– → 3Cu

পূর্ণ কোষ বিক্রিয়া : 2Al + 3Cu2+ → 2Al3+ + 3Cu
কোষ সংকেত বা কোষ ডায়াগ্রাম: Al(s)/Al3+(aq) (1M) ∥ Cu2+(aq) (2M) /Cu(s)
খ নং প্রশ্নের উত্তর – উদ্দীপকের কোষটির কোষ নির্ণয়
অ্যানোড তড়িৎদ্বারে বিক্রিয়া(জারন): Al → Al3+ + 3e–
ক্যাথোড তড়িৎদ্বারে বিক্রিয়া(বিজারন): Cu2+ + 2e– → Cu
(i) ×2 এবং (ii) ×3 করে যোগ করি-
অ্যানোড তড়িৎদ্বারে বিক্রিয়া(জারন): 2Al → 2Al3+ + 6e–
ক্যাথোড তড়িৎদ্বারে বিক্রিয়া(বিজারন): 3Cu2+ + 6e– → 3Cu

পূর্ণ কোষ বিক্রিয়া : 2Al + 3Cu2+ → 2Al3+ + 3Cu
কোষ সংকেত বা কোষ ডায়াগ্রাম: Al(s)/Al3+(aq) (1M) ∥ Cu2+(aq) (2M) /Cu(s)
আমরা জানি,
E0cell = E0red(cathode) – E0red(anode)
বা, E0cell = +0.34 – (-1.66)
প্রমান কোষ বিভব = + 2 V
বা, E0cell = + 2
এখানে,
Al/Al3+ = +1.66 V
বা, Al3+/Al = -1.66V
Cu/Cu2+ = – 3.4 V
বা, Cu2+/Cu = +0.34V
যেহেতু প্রমান কোষ বিভব বা E0cell এর মান ধনাত্মাক সেহেতু বিক্রিয়াটি স্বতঃস্ফূর্ভাবে ঘটবে
গ – নং প্রশ্নের উত্তর- উদ্দীপকের কোষের A পাত্রটি যদি লোহা নির্মিত হয় তবে A পাত্রে Al2(SO4)3 দ্রবণ রাখা যাবে কি ? গাণিতিকভাবে বিশ্লেষণ করো।
A পাত্রটি আয়রন নির্মিত হলে A পাত্রে Al2(SO4)3 দ্রবণ দীর্ঘসময় সংরক্ষণে দুইটি বিষয় বিবেচ্য হবে।
i. Fe অ্যানোড হিসেবে ব্যবহৃত হচ্ছে কিনা।
ii. Fe অ্যানোড হিসেবে ব্যবহৃত হলে বিক্রিয়া স্বতঃস্ফূর্তভাবে ঘটছে কিনা।
Fe অ্যানোড হলে এক্ষেত্রে সংশ্লিষ্ট বিক্রিয়া হবে-
অ্যানোড তড়িৎদ্বারে বিক্রিয়া(জারন): Fe → Fe2+ + 2e–
ক্যাথোড তড়িৎদ্বারে বিক্রিয়া(বিজারন): Al3+ + 3e– → Al
(i) ×2 এবং (ii) ×3 করে যোগ করি-
অ্যানোড তড়িৎদ্বারে বিক্রিয়া(জারন): 3Fe → 3Fe2+ + 6e–
ক্যাথোড তড়িৎদ্বারে বিক্রিয়া(বিজারন): 2Al3+ + 6e– → 2Al

পূর্ণ কোষ বিক্রিয়া : 3Fe + 2Al3+ → 3Fe2+ + 2Al
কোষ সংকেত বা কোষ ডায়াগ্রাম: Fe(s)/Fe2+(aq) ∥ Al3+(aq)/Al(s)
আমরা জানি,
E0cell = E0red(cathode) – E0red(anode)
বা, E0cell = (-1.66) – (+0.44)
বা, E0cell = – 1.22
প্রমান কোষ বিভব = – 1.22 V
এখানে,
Al3+/Al = – 1.66 V
Fe2+/Fe = – 0.44 V
যেহেতু প্রমান কোষ বিভব বা E0cell এর মন ঋনাত্মাক সেহেতু বিক্রিয়াটি স্বতঃস্ফূর্ত ভাবে ঘটবে না অথাৎ পাত্রক্ষয়প্রাপ্ত হয় না। এজন্য B লোহার পাত্রে Al2(SO4)3 দ্রবণ রাখা যাবে ।
ঘ) উদ্দীপকের কোষের B পাত্রটি যদি লেড নির্মিত হয় তবে B পাত্রে CuSO4 দ্রবণ রাখা যাবে কি ? গাণিতিকভাবে বিশ্লেষণ করো।
B পাত্রটি আয়রন নির্মিত হলে B পাত্রে CuSO4 দ্রবণ দীর্ঘসময় সংরক্ষণে দুইটি বিষয় বিবেচ্য হবে।
i. Pb অ্যানোড হিসেবে ব্যবহৃত হচ্ছে কিনা।
ii. Pb অ্যানোড হিসেবে ব্যবহৃত হলে বিক্রিয়া স্বতঃস্ফূর্তভাবে ঘটছে কিনা।
Fe অ্যানোড হলে এক্ষেত্রে সংশ্লিষ্ট বিক্রিয়া হবে-
অ্যানোড তড়িৎদ্বারে বিক্রিয়া (জারন): Pb → Pb2+ + 2e–
ক্যাথোড তড়িৎদ্বারে বিক্রিয়া (বিজারন): Cu2+ + 2e– → Cu

পূর্ণ কোষ বিক্রিয়া : Pb + Cu2+ → Pb2+ + Cu
কোষ সংকেত বা কোষ ডায়াগ্রাম : Pb(s)/Pb2+(aq) ∥ Cu2+(aq)/Cu(s)
আমরা জানি,
বা, E0cell = (+0.34) – (-0.12)
E0cell = E0red(cathode) – E0red(anode)
বা, E0cell =+ 0.46 V
এখানে,
Pb2+/Pb = – 0.12 V
Cu2+/Cu = + 0.34 V
প্রমান কোষ বিভব = + 0.46 V
যেহেতু প্রমান কোষ বিভব বা E0cell এর মান ধনাত্মাক সেহেতু বিক্রিয়াটি স্বতঃস্ফূর্ত ভাবে ঘটবে অথাৎ পাত্রক্ষয়প্রাপ্ত হয় । এজন্য B লেডের পাত্রে CuSO4 দ্রবণ রাখা যাবে না।
ঙ) উদ্দীপকের কোষটির কোষ বিভব(Cell Potential) অথবা Ecell এর মান নির্ণয় কর।
অ্যানোড তড়িৎদ্বারে বিক্রিয়া(জারন): Al → Al3+ + 3e–
ক্যাথোড তড়িৎদ্বারে বিক্রিয়া(বিজারন): Cu2+ + 2e– → Cu
(i) ×2 এবং (ii) ×3 করে যোগ করি-
অ্যানোড তড়িৎদ্বারে বিক্রিয়া(জারন): 2Al → 2Al3+ + 6e–
ক্যাথোড তড়িৎদ্বারে বিক্রিয়া(বিজারন): 3Cu2+ + 6e– → 3Cu

পূর্ণ কোষ বিক্রিয়া : 2Al + 3Cu2+ → 2Al3+ + 3Cu
কোষ সংকেত বা কোষ ডায়াগ্রাম: Al(s)/Al3+(aq) (1M) ∥ Cu2+(aq) (2M)
আমরা জানি,
E0cell = E0red(cathode) – E0red(anode)
বা, E0cell = +0.34 – (-1.66)
প্রমান কোষ বিভব = + 2 V
বা, E0cell = + 2
প্রমান কোষ বিভব = + 2 V
এখানে,
Al/Al3+ = +1.66 V
বা, Al3+/Al = -1.66V
Cu/Cu2+ = – 3.4 V
বা, Cu2+/Cu = +0.34V
আবার, আমরা জানি,
$$E_{cell}\;=E_{cell^0}^0\;-\;\frac{(2.303\times RT}{eF}\times log\frac{{\lbrack Al^{3+}\rbrack}^2}{{\lbrack Cu^{2+}\rbrack}^3}$$
$$or,\;\;E_{cell}\;=\;2\;-\;\frac{2.303\times8.314\times298}{6\times96500}\times log\frac{{(1)}^2}{{(2)}^3}$$
$$or,\;\;E_{cell}\;=\;2\;-\;{(0.009854)\times(-0.90308)}$$
$$or,\;\;E_{cell}\;=\;2\;-(-0.008898)\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;$$
$$or,\;\;E_{cell}\;=\;2.0089\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;$$
কোষ বিভব = 2.0089 V
এখানে,
Al3+/Al= +1.66 V
Cu2+/Cu = + 0.34V
T = (25+273)K = 298 K
R = 8.314 j mol-1 K-1
1F = 96500C , n = 6
[Al3+] = 1M এবং [Cu2+] = 2M
E0cell = + 2 V
Ecell = ?