প্রশ্ন: পর্যায়বৃত্ত ধর্ম কী?
উত্তর: মৌলসমূহের ইলেকট্রন বিন্যাস পারমাণবিক সংখ্যার বৃদ্ধির সাথে পরিবর্তিত হয়ে থাকে এবং মৌলের ধর্মের পর্যায়বৃত্ততা ঘটতে দেখা যায়। মৌলসমূহের ধর্মাবলি একইভাবে ইলেকট্রন বিন্যাসের উপর নির্ভর করে পরিবর্তিত হয়ে পুনরাবৃত্তি ঘটে। এ কারণে মৌলসমূহের ইলেকট্রন বিন্যাসভিত্তিক পরিবর্তনশীল ধর্মসমূহকে পর্যায়বৃত্ত ধর্ম বলা হয়।
পর্যায় সারণির কোন পর্যায়ের বামদিক হতে ডান দিকে এবং কোনো গ্রুপের উপর হতে নিচের দিকে অগ্রসর হলে এ সকল ধর্মাবলি একটি নির্দিষ্ট নিয়মের অধীনে পর্যায়ক্রমে বিভিন্নতা প্রদর্শন করে। আর এ কারণেই এদেরকে পর্যায়বৃত্ততা বলা হয়।
প্রশ্ন: ক্ষার ধাতু কী?
উত্তর: যে সকল ধাতু পানির সঙ্গে সরাসরি বিক্রিয়া করে এবং তীব্র ক্ষার গঠন করে তাকে ক্ষার ধাতু বলে। ক্ষার ধাতু পর্যায় সারণীর Gr IA শ্রেণীভুক্ত। এরা খুব সক্রিয় বলে মুক্ত অবস্থায় প্রকৃতির মধ্যে পাওয়া যায় না। যেমন, হাইড্রোজেন, লিথিয়াম, সোডিয়াম, পটাসিয়াম, রুবিডিয়াম, সিজিয়াম, ফ্রান্সিয়াম ইত্যাদি ক্ষার ধাতু।
প্রশ্ন: s-ব্লক মৌল কী?
উত্তর : s-ব্লক মৌল: যে সকল মৌলের ইলেকট্রন বিন্যাসে সর্বশেষ ইলেকট্রন s অরবিটালে প্রবেশ করে তাদেরকে s- ব্লক মৌল বলে। s-ব্লক মৌলের সংখ্যা ১৪ । 11 Na = 1s2 2s2 2p6 3s1
প্রশ্ন: p-ব্লক মৌল কী?
উত্তর : p-ব্লক মৌল:যে সকল মৌলের ইলেকট্রন বিন্যাসে সর্বশেষ ইলেকট্রন p অরবিটালে প্রবেশ করে তাদেরকে p-ব্লক মৌল বলে। p-ব্লক মৌলের সংখ্যা 36। গ্রুপ-13(IIIA) থেকে 18 (VIIA এবং শূণ্য শ্রেণী) পর্যন্ত মৌলসমূহ p-ব্লক মৌল । 13 Al= 1s2 2s2 2p6 3s2 3p6
প্রশ্ন: d-ব্লক মৌল কী?
উত্তর : d-ব্লক মৌল: যে সকল মৌলের ইলেকট্রন বিন্যাসে সর্বশেষ ইলেকট্রন d অরবিটালে প্রবেশ করে তাদেরকে d-ব্লক মৌল বলে। d-ব্লক মৌলের সংখ্যা 41 টি।
প্রশ্ন: f-ব্লক মৌল কী?
উত্তর : f-ব্লক মৌল: যে সকল মৌলের ইলেকট্রন বিন্যাসে সর্বশেষ ইলেকট্রন f অরবিটালে প্রবেশ করে তাদেরকে f-ব্লক মৌল বলে। f-ব্লকে মোট 27 টি মৌল আছে।
প্রশ্ন: নিকটোজেন কী?
পর্যায় সারণির p-ব্লক মৌলের অন্তর্ভূক্ত গ্রুপ-15 এর মৌলসমূহ (N, P, As, Sb, Bi) কে নিকটোজেন বলা হয়। নিকটোজেন শব্দের অর্থ শ্বাসরোধকারী। গ্রুপ-15 এর প্রথম মৌল হচ্ছে নাইট্রোজেন এবং এই নাইট্রোজেন একটি শ্বাসরোধকারী গ্যাস হওয়ায় এই গ্রুপের নাম দেওয়া হয়েছে নিকটোজেন।
প্রশ্ন: চালকোজেন কী?
উত্তর: পর্যায় সারণির p-ব্লক মৌলের অন্তর্ভুক্ত গ্রুপ-16 এর মৌলসমূহের মধ্যে অক্সিজেন (O), সালফার (S), সেলেনিয়াম (Se), ও টেলুরিয়াম (Te) কে একত্রে চালকোজেন বলা হয়। চালকোজেন শব্দের অর্থ আকরিক উৎপাদনকারী মৌল। সাধারণ অধিকাংশ ধাতুসমূহকে তাদের অক্সাইড ও সালফাইড আকরিক হিসেবে পাওয়া যায়। তাই গ্রুপ 16 এর মৌলসমূহকে চালকোজেন বলে।
প্রশ্ন: আন্তঃহ্যালোজেন যৌগ কি?
উত্তর : আন্তঃহ্যালোজেন যৌগ: কম তড়িৎ ঋণাত্মক হ্যালোজেন পরমাণুর সাথে অধিক তড়িৎ ঋণাত্মক হ্যালোজেন পরমাণ যুক্ত হয়ে যে সকল যৌগ গঠন করে তাদেরকে আন্তঃহ্যালোজেন যৌগ বলে। যেমন- (i) ক্লোরিন ট্রাই ফ্লোরাইড – CIF3 (ii) আয়োডিন পেন্টা ক্লোরাইড – ICI5
প্রশ্ন: অবস্থান্তর মৌল কী?
উত্তর : অবস্থান্তর মৌল: যে সকল d-ব্লক মৌলের সুস্থিত আয়নের ইলেকট্রন বিন্যাসে d অরবিটাল ইলেকট্রন দ্বারা আংশিক পূর্ণ (d1-9) থাকে, তাদেরকে অবস্থান্তর মৌল বলে ।
প্রশ্ন: জটিল যৌগ কী?উত্তর : জটিল যৌগ: অবস্থান্তর ধাতব পরমাণু বা আয়নের সাথে একাধিক লিগ্যান্ড সন্নিবেশ বন্ধন দ্বারা যুক্ত হয়ে জটিল আয়ন গঠন করে। এ জটিল আয়ন দ্বারা গঠিত যৌগকে জটিল যৌগ বলে।
প্রশ্ন: লিগ্যান্ড কি?
উত্তর : লিগ্যান্ড: জটিল যৌগে উপস্থিত কেন্দ্রীয় ধাতু বা ধাতব আয়নের সাথে মুক্তজোড় ইলেকট্রন বিশিষ্ট যে সকল অণু বা ঋণাত্মক আয়ন সন্নিবেশ বন্ধনের মাধ্যমে যুক্ত থাকে তাদেরকে লিগ্যান্ড বলে। যেমন, NH3, H2O ইত্যাদি প্রশম লিগ্যান্ড, আবার CN–, Cl– ইত্যাদি ঋণাত্নক লিগ্যান্ড।
প্রশ্ন: সন্নিবেশ সংখ্যা কি?
উত্তর : সন্নিবেশ সংখ্যা: জটিল যৌগ গঠনে কেন্দ্রীয় ধাতব আয়নের সাথে যুক্ত লিগ্যান্ডের সংখ্যাকে সন্নিবেশ সংখ্যা বলে। যেমন- [Cu(NH3)4]SO4 জটিল যৌগে কপারের সন্নিবেশ সংখ্যা 4।
প্রশ্ন: আয়নিকরণ শক্তি কি ?
উত্তর: আয়নিকরণ শক্তি: গ্যাসীয় অবস্থায় কোনো মৌলের এক মোল বিচ্ছিন্ন পরমাণু হতে একটি করে এক মোল ইলেকট্রন অপসারিত করে এক মোল গ্যাসীয় একক ধনাত্মক আয়নে পরিণত করতে যে পরিমাণ শক্তির প্রয়োজন হয় তাকে আয়নিকরণ শক্তি বলে।
প্রশ্ন: ইলেকট্রন আসক্তি কি?
উত্তর : ইলেকট্রন আসক্তি: গ্যাসীয় অবস্থায় কোনো মৌলের এক মোল বিচ্ছিন্ন পরমাণুতে একটি করে এক মোল ইলেকট্রন যুক্ত করে এক মোল গ্যাসীয় ঋণাত্মক আয়নে পরিণত করতে যে পরিমাণ শক্তি নির্গত হয় তাকে ইকেট্রন আসক্তি বলে।
Cl(s) + e → Cl– (g) 1 mole 1mole
প্রশ্ন: তড়িৎ ঋণাত্মকতা কি?
উত্তর : তড়িৎ ঋণাত্মকতা: সমযোজী যৌগের অণুতে উপস্থিত দুইটি ভিন্ন পরমাণুর মধ্যে বন্ধনের শেয়ারকৃত ইলেকট্রন যুগলকে একটি পরমাণু নিজের দিকে অধিক আকর্ষণ করার ক্ষমতাকে তড়িৎ ঋণাত্মকতা বলে।
প্রশ্ন: সিগমা ও পাই বন্ধন বলতে কি বুঝ?
উত্তর : সিগমা বন্ধন: একই অক্ষে অবস্থিত দুটি অরবিটালের সামনাসামনি অধিক্রমনের মাধ্যমে যে বন্ধন গঠিত হয় তাকে সিগমা বন্ধন বলে। যেমন-ফ্লোরিন পরমাণুর অযুগল ইলেকট্রনধারী দুটি অরবিটাল সামনাসামনি অধিক্রমনের মাধ্যমে সিগমা বন্ধন গঠন করে।

প্রশ্ন: আদর্শ মৌল (Ideal elements) কী?
উত্তর: প্রকৃতিতে দ্বিতীয় ও তৃতীয় পর্যায়ের মৌল গুলো যতেষ্ঠ পরিমাণে পাওয়া যায়। যেকোনো মৌলকে প্রথম মৌলর ধরে সামনের দিকে অগ্রসর হলে এ মৌলটির সাথে তৃতীয় পর্যায়ের মৌলটির ধর্মের সাদৃশ্য পাওয়া যায়। অর্থাৎ এক্ষেত্রে নিয়মিত ব্যবধানে মৌলের ধমের পুনরাবৃত্তি ঘটে। এজন্য দ্বিতীয় ও তৃতীয় পর্যায়ের মৌলগুলোকে আদর্শ মৌল বলা হয়।
প্রশ্ন: প্রতিরূপী বা প্রতিনিধিত্ব (Representative elements) মৌল কী?
উত্তর: যেসব মৌলের অভ্যন্তরীণ সকল অরবিটাল পরিপূর্ণ থাকে কিন্তু যোজ্যতা স্তর অপূর্ণ থাকে তারা প্রতিরূপী মৌল বা আদর্শ মৌল। প্রতিরূপী মৌলসমূহের যোজ্যতাস্তরের ইলেকট্রন বিন্যাস ns1 হতে ns2np5 হয়ে থাকে।
প্রশ্ন: হ্যালোজেন কী ?
উত্তর: পর্যায় সারণির 17-তম গ্রুপের ফ্লোরিন (F), ক্লোরিন (Cl), আয়োডিন (I) ও অ্যাস্টাটিন (At) এ পাঁচটি মৌলকে হ্যালোজেন মৌল বলা হয়।হ্যালোজেন অর্থ সামুদ্রিক লবণ উৎপাদক। সামুদ্রিক লবণের উপাদান হিসেবে এদের পাওয়া যায় বলে এ ধরনের নামকরণ করা হয়েছে।
প্রশ্ন: ছদ্ম হ্যালোজেন (Pseudohalogens) কী?
উত্তর: দুই বা ততোধিক তড়িৎ ঋণাত্মক পরমাণু যুক্ত হয়ে একক ঋণাত্মক অজৈব গ্রুপ সৃষ্টি করে যা হ্যালাইড আয়নের মতো সাদৃশ্য দেখায়। এ ধরনের আয়নগুলোকে ছদ্ম হ্যালাইড আয়ন বলে। সায়ানাইড আয়ন (CN–), থায়োসায়ানেট আয়ন (SCN–), সেলেনো সায়ানেট আয়ন (SeCN–), সায়ানেট আয়ন (OCN–) ইত্যাদি।এদের মধ্যে আবার কিছু ডাইমারিক হিসাবে পাওয়া যায়। সেগুলো হলো- সায়ানোজেন [(CN)2] থায়োসায়ানোজেন [(SCN)2], সায়ানোজেন [SeCN)2], অ্যাজিডো কার্বন ডাইসালফাইড [(SCSN3)2] এ অণু হ্যালোজেন অণুর মতো একই রকম ধর্ম প্রদর্শন করে বলে এদেরকে ছদ্ম হ্যালোজেন বলা হয়।
প্রশ্ন: আন্তঃহ্যালোজেন যৌগ গঠন কী?
উত্তর: প্রয়োজনীয় চাপ ও তাপমাত্রায় একটি ভারী হ্যালোজেনের সাথে বিজোড় সংখ্যক হালকা হ্যালোজেন পরমাণু যুক্ত হয়ে দ্বিমৌল যৌগ আন্তঃহ্যালোজেন যৌগ গঠন করে। A যদি ভারী হ্যালোজেন ও B হালকা হ্যালোজেন পরমাণু হয় তবে এরা পরস্পর যুক্ত হয়ে AB, AB3, AB5 ও AB7 এ চার জাতীয় দ্বিমৌল যৌগ গঠন করে। এ দ্বিমৌল যৌগকে আন্তঃহ্যালোজেন যৌগ বলা হয়। যেমন- BrF, BrCl, CIF, CIF3, BrF3, BrF5, CIF5, IF5, IF7 ইত্যাদি আন্তঃহ্যালোজেন যৌগের উদাহরণ। মূলত হ্যালোজেনসমূহের মধ্যে তড়িৎ ঋণাত্মকতার পার্থক্যের কারণে এদের মধ্যে এ জাতীয় দ্বিমৌল যৌগ গঠিত হয়। হ্যালোজেনসমূহের মধ্যে তড়িৎ ঋণাত্মকতার পার্থক্য কম হওয়ায় এরূপ যৌগের প্রকৃতি হয় সমযোজী। এসব যৌগ উদ্ধায়ী এবং বিস্ফোরক প্রকৃতির। আয়োডিন ভারী হ্যালোজেন বলে বেশি সংখ্যক আন্তঃহ্যালোজেন যৌগ গঠন করে।
প্রশ্ন: বিরল মৃত্তিকা মৌল কী?
উত্তর: পর্যায় সারণির ৬ষ্ঠ পর্যায়ে ল্যান্থানাইড La(57) এর পরবর্তী মৌল সেরিয়াম, Ce(58) থেকে লুটেসিয়াম, Lu(71) পর্যন্ত 14 টি মৌল ল্যান্থানাইড মৌলকে মধ্যে ভৌত ও রাসায়নিক ধর্মের সাদৃশ্য লক্ষ করা যায়। এ 14 টি মৌলকে পর্যায় সারণির নিচে একটি সম্পূর্ন আলাদা আনুভূমিক সারিতে সারিতে স্থান দেয়া হয়েছে। এ 14 টি মৌলকে ল্যান্থানাইড বলা হয়। প্রকৃতিতে এর অতি অল্প পরিমাণে পাওয়া যায় বলে বিরল মৃত্তিকা বলে।
প্রশ্ন: f-ব্লক মৌল কী?
উত্তর: যে সব মৌলের ইলেকট্রন বিন্যাসে সর্বশেষ ইলেকট্রনটি f অরবিটালে প্রবেশ করে সেগুলোকে f-ব্লক মৌল বলা হয়। ল্যান্থানাইড (4f সিরিজ) এবং অ্যাকটিনাইড (5f সিরিজ) মৌলসমূহ f ব্লকের অন্তর্ভুক্ত।
এদের বহিঃস্তরে ইলেকট্রন বিন্যাস (n-2)f1-14 (n-1)d1-10 ns1-2 [n হলো প্রধান কোয়ান্টাম সংখ্যা,যা পর্যায় সংখ্যা নির্দেশ করে] ।
প্রশ্ন: অন্তঃ অবস্থান্তর মৌল কী?
উত্তর: যে সব মৌলের স্থিতিশীল আয়নের ইলেকট্রন বিন্যাসে f অরবিটাল আংশিক পূর্ণ (f1 হতে f13) হয় তাদেরকে অন্তঃ অবস্থান্তর মৌল (Inner Transition Element) বলা হয়। যেমন- সেরিয়াম Ce (58) ।
উত্তর: যে সব মৌলের স্থিতিশীল আয়নের ইলেকট্রন বিন্যাস (n -1)d1-9 তাদের অবস্থান্তর মৌল বলে।
প্রশ্ন: অভ্যন্তরীণ অবস্থান্তর মৌল কী?
উত্তর: যে সব মৌলের স্থিতিশীল আয়নের ইলেকট্রন বিন্যাস (n – 2)fl-13 তাদের অভ্যন্তরীণ অবস্থান্তর মৌল বলে।
প্রশ্ন: চিলেট বা কিলেট যৌগ কী?
উত্তর: চিলেট বা কিলেট (Chelate) : একই লিগ্যান্ডের দুই প্রান্তের দুটি পরমাণু কেন্দ্রিয় পরমাণুর সাথে দুটি সন্নিবেশ বন্ধনের মাধ্যমে যুক্ত হয়ে যে যৌগ গঠন করে তাকে চিলেট যৌগ বলে। ইহার গঠনকে কাকড়ার কামড়ের সাথে তুলনা করা যায়। উদাহরণ-
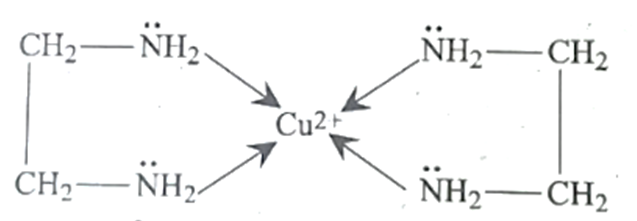
প্রশ্ন: s-ব্লক মৌল কী?
উত্তর: যে সব মৌলের ইলেকট্রন বিন্যাসে সর্বশেষ ইলেকট্রনটি s অরবিটালে প্রবেশ করে সেগুলোকে s -ব্লক মৌল বলা হয়। পর্যায় সারণির গ্রুপ IA এবং গ্রুপ IIA এর মৌলসমূহ এবং শূন্য গ্রুপের He s- ব্লকের অন্তর্ভুক্ত। যেমন-H (1) – 1s1 ।
Mg (12) – 1s2 2s2 2p6 3s2
প্রশ্ন: পোলারায়ন (Polarization) কী?
উত্তর : যখন কোনো ক্যাটায়ন একটি অ্যানায়নের খুব নিকটে আসে, তখন ক্যাটায়নের সামগ্রিক ধনাত্মক চার্জ অ্যানায়নের ইলেকট্রন মেঘকে নিজের দিকে আকর্ষণ করে। একই সাথে ক্যাটায়নটি অ্যানায়নের নিউক্লিয়াসকে বিকর্ষণ করে। এই আকর্ষণ ও বিকর্ষণের ফলে অ্যানায়নের ইলেকট্রন মেঘ ক্যাটায়নের দিকে সরে আসে একে পোলারায়ন বলে।
প্রশ্ন: অরবিট কী?
উত্তর : নিউক্লিয়াসের চারদিকে যে সুনির্দিষ্ট বৃত্তাকার কক্ষপথে ইলেকট্রনসমূহ আবর্তন করে সেই বৃত্তাকার কক্ষপথই হচ্ছে অরবিট।
প্রশ্ন: অরবিটাল কাকে বলে?
উত্তর : পরমাণুর নিউক্লিয়াসকে কেন্দ্র করে বিভিন্ন শক্তিস্তরের যেসব অঞ্চলে ইলেকট্রন থাকা বা পাওয়ার সম্ভাবনা সবচেয়ে বেশি সেই অঞ্চলকে অরবিটাল বলে।
প্রশ্ন: সমযোজী ব্যাসার্ধ কাকে বলে?
উত্তর : একটি একক সমযোজী বন্ধনে যুক্ত একই মৌলের দুটি পরমাণু যোগে গঠিত অণুতে পরমাণুদ্বয়ের নিউক্লিয়াসের মধ্যবর্তী দূরত্বের অর্ধেককে উক্ত মৌলের পরমাণুর সমযোজী ব্যাসার্ধ বলা হয়।
প্রশ্ন: অরবিটাল সংকরণ কী?
উত্তর : বিক্রিয়াকালে কোনো পরমাণুর যোজ্যতা স্তরের বিভিন্ন অরবিটালসমূহ পরস্পরের সাথে মিশ্রিত হয়ে পরে সমশক্তির অরবিটাল সৃষ্টির প্রক্রিয়াকে অরবিটাল সংকরণ বা হাইব্রিডাইজেশন বলে।
প্রশ্ন: আণবিক অরবিটাল কী?
উত্তর: দুটি অরবিটালের অধিক্রমণের ফলে পরমাণু দুটির নিউক্লিয়াসের মাঝামাঝি স্থানে ইলেকট্রন মেঘের সাধারণ ঘনত্ব বিশিষ্ট একটি ক্ষেত্র সৃষ্টি হয়, এটাকে আণবিক অরবিটাল বলা হয়। এ অবস্থায় উভয় পরমাণুর নীট আকর্ষণ শক্তি সর্বাধিক হয়।
প্রশ্ন : sp2– হাইব্রিডাইজেশন কাকে বলে?
উত্তর : যে প্রক্রিয়ায় 1টি s ও দুইটি p অরবিটাল পরস্পর যুক্ত হয়ে একই শক্তির অভিন্ন নতুন তিনটি হাইব্রিড অরবিটাল উৎপন্ন করে তাকে sp2– হাইব্রিডাইজেশন বলে।
প্রশ্ন : পোলার যৌগ কী?
উত্তর : সমযোজী যৌগে আবদ্ধ দুটি পরমাণুর মধ্যে তড়িৎ ঋণাত্মকতার পার্থক্য অনেক বেশি হলে যৌগটিকে পোলার যৌগ বলে।
প্রশ্ন: পোলারিটি কাকে বলে?
উত্তর : সমযোজী যৌগের অণুতে ডাইপোল সৃষ্টির ধর্মকে সেই যৌগের পোলারিটি বলে।
প্রশ্ন: ভ্যানডার ওয়াল আকর্ষণ বল কী?
উত্তর : অপোলার সমযোজী যৌগসমূহের একটি অণু অন্যান্য অণু কর্তৃক যে দুর্বল এবং ক্ষণস্থায়ী আকর্ষণ বল দ্বারা আকৃষ্ট হয় তাই
ভ্যানডার ওয়াল আকর্ষণ বল।
প্রশ্ন: হাইড্রোজেন বন্ধন কাকে বলে?
উত্তর : হাইড্রোজেনযুক্ত পোলার অণুসমূহ যখন পরস্পর পরস্পে সান্নিধ্যে আসে, তখন এক অণুর ধনাত্মক (হাইড্রোজেন) প্রন্ত অণুর ঋণাত্মক প্রান্তের দিকে বিশেষভাবে আকর্ষিত হয়। এ বন্ধনকে হাইড্রোজেন বন্ধন বলে।
প্রশ্ন: হাইড্রেশন শক্তি কী?
উত্তর: এক মোল আয়নিক যৌগ পানিতে দ্রবীভূত হলে যে পরিমাণ শক্তি নির্গত হয় তাকে আয়নিক যৌগের হাইড্রেশন শক্তি বলে।
প্রশ্ন: ল্যাটিস শক্তি কী?
উত্তর: গ্যাসীয় ক্যাটায়ন ও অ্যানায়ন থেকে 1 মোল পরিমাণ আয়নিক কেলাস গঠনের সময় যে পরিমাণ শক্তির বিমুক্ত হয় তাকে ল্যাটিস শক্তি বলে।
প্রশ্ন: সমযোজী বন্ধন বলে কী?
উত্তর: রাসায়নিক বন্ধনে অংশগ্রহণকারী একই বা ভিন্ন অধাতব মৌলের পরমাণু দুটির নিজ নিজ যোজ্যতা স্তরের সমান সংখ্যক বিজোড় ইলেকট্রন এক বা একাধিক ইলেকট্রন জোড় গঠন করে। প্রাথমিক অবস্থায় গঠিত ইলেকট্রন জোড় পরমাণুদ্বয়ের নিউক্লিয়াস দ্বারা সমানভাবে ব্যবহৃত হয়ে পরমাণু দুটি যে রাসায়নিক বন্ধন গঠন করে তাকে সমযোজী বন্ধন বলে।
প্রশ্ন: ম্যাজিক নাম্বার কী?
উত্তর: ম্যাজিক নাম্বার (Magic Number) : মৌলগুলোকে ক্রমবর্ধমান পারমাণবিক সংখ্যা অনুসারে সাজালে 2, 8, 8, 18, 18, 32 এ সংখ্যার ব্যবধানে আধুনিক পর্যায় সারণিতে মৌলগুলোর ধর্মের পুনরাবৃত্তি ঘটে এবং মৌলগুলোর ইলেকট্রন বিন্যাসও একইরূপ হয়। এ 2, 8, 18 এবং 32 সংখ্যাগুলোকে ম্যাজিক নাম্বার বা ম্যাজিক সংখ্যা বলা হয়।
প্রশ্ন: আবরনী প্রভাব কী?
উত্তর: আবরনী প্রভাব (Screening effect): পরমাণুর নিউক্লিয়াসকে ঘিরে যে সমস্ত ইলেকট্রনপূর্ণ উপশক্তিস্তর গুলো আছে, সেগুলো বহিস্থ শক্তিস্তরে উপস্থিত ইলেকট্রনের উপর নিউক্লিয়াসের আকর্ষণ বলের প্রভাব কমিয়ে দেয়। অন্তবর্তী উপশক্তিস্তর পূর্ন ইলেকট্রনের নিউক্লিয় আধানকে আড়াল করার এই ক্ষমতাকে আবরনী প্রভাব বলা হয়।
প্রশ্ন: আচ্ছাদন প্রভাব কী?
উত্তর: আচ্ছাদন প্রভাব (Shielding effect): প্রত্যেকটি পরমাণুর নিউক্লিয়াসই তার যোজ্যতাস্তরের ইলেকট্রনকে আকর্ষণ করে। একইভাবে যেসব পরমাণু বহু সংখ্যক ইলেকট্রন ধারন করে তাদের নিউক্লিয়াসেও যোজ্যতা স্তরের ইলেকট্রনকে আকর্ষণ করে। তবে এ আকর্ষণ তুলনামূলকভাবে কম, কারণ নিউক্লিয়াস থেকে যোজ্যতা স্তরের পূর্ববর্তী স্তরে বিদ্যমান মধ্যবর্তী ইলেকট্রনগুলোর প্রভাবে নিউক্লিয়াস যোজ্যতাস্তরের ইলেকট্রনকে আশানুরূপ আকর্ষণ করতে পারে না। মধ্যবর্তী স্তরের ইলেকট্রনগুলোর প্রভাবই হলো আচ্ছাদন প্রভাব। পরমাণূর মধ্যে আচ্ছাদন প্রভাব বৃদ্ধি পেলে আয়নিকরণ বিভব হ্রাস পায়।
প্রশ্ন: সংজ্ঞা লিখ।
(i). ক্ষার ধাতু [ব.বো-১৯]
(ii). মৃৎক্ষার ধাতু [মা.বো-১৮,ঢা.বো, য.বো-২১]
(iii). আন্ত:অবস্থান্তর মৌল
(iv). বিরল মৃত্তিকা মৌল
(v). তেজস্ক্রিয় মৌল
(vii). আধুনিক পর্যায় সূত্র
(vi). হাইড্রেশন
উত্তর: ক্ষার ধাতু (Alkali Metals): পর্যায় সারণীর গ্রুপ IA এর মৌলসমূহ পানির সাথে বিক্রিয়া করে তীব্র ক্ষার উৎপন্ন করে এ জন্য এদেরকে ক্ষার ধাতু বলে। এরা তীব্র তড়িৎ ধনাত্মক মৌল। ইহাদের বহিস্থ শক্তিস্তরের সাধারণ ইলেকট্রন বিন্যাস ns1। যেমন: 2Na + 2H2O → 2NaOH + H2
মৃৎক্ষার ধাতু (Alkaline Earth Metals): পর্যায় সারণীর গ্রুপ IIA এর মৌলসমূহ পানির সাথে বিক্রিয়া করে ক্ষারক উৎপন্ন করে। কতিপয় মৌল, যেমন: Ca ও Mg কে যৌগ রূপে মাটিতে পাওয়া যায় তাই এদেরকে মৃৎক্ষার ধাতু বলা হয়। ইহাদের বহিস্থ শক্তিস্তরের সাধারণ ইলেকট্রন বিন্যাস ns2।
যেমন: Mg + 2H2O → Mg(OH)2 + H2
আন্ত:অবস্থান্তর মৌল: যে সব মৌলের স্থিতিশীল আয়নের ইলেকট্রন বিন্যাসে আংশিক পূর্ন f অরবিটাল (f1-13) থাকে তাদেরকে আন্ত:অবস্থান্তর মৌল বলে। উদাহরণ সেরিয়াম Ce।
বিরল মৃত্তিকা মৌল: ল্যান্থানাইড সারির মৌলগুলোর প্রাচুর্যতা খুবই কম, তাই এদেরকে বিরল মৃত্তিকা মৌল বলে।
তেজস্ক্রিয় মৌল: সাধারণত অ্যাক্টিনাইড সারির মৌলগুলো বিভিন্ন ধরনের তেজস্ক্রিয় রশ্মি বিকিরন করে তাই ইহারা তেজস্ক্রিয় মৌল ।
হাইড্রেশন: সাধারণত কোন ক্যাটায়ন বা অ্যানায়নের আকার ক্ষুদ্র এবং চার্জ ঘনত্ব বেশি হলে জলীয় দ্রবণে ঐ আয়নের চারিদিকে নির্দিষ্ট সংখ্যক পানির অণু আকৃষ্ট হয়ে পরিবেষ্টিত থাকে, ইহাকে হাইড্রেশন বলে।
আধুনিক পর্যায় সূত্র: বিভিন্ন মৌলের ভৌত ও রাসায়নিক ধর্মাবলি তাদের পারমাণবিক সংখ্যা বৃদ্ধির সঙ্গে পর্যায়ক্রমে আবর্তিত হয়। এটি আধুনিক পর্যায় সূত্র।